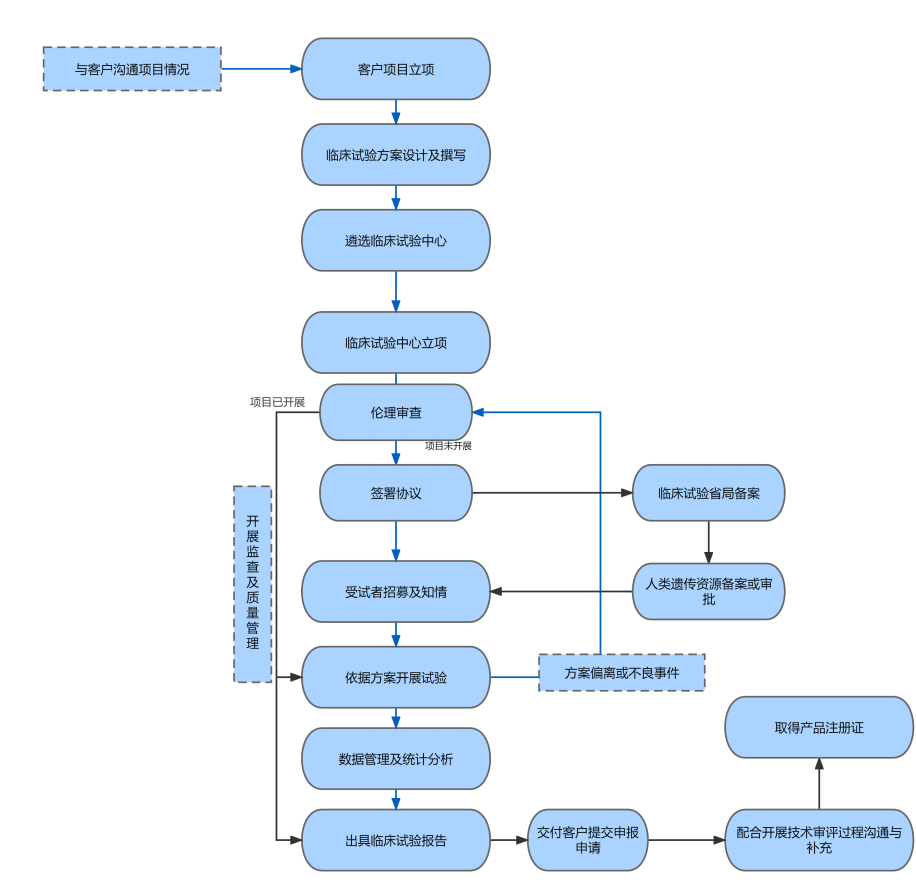
临床试验临床试验临床评价是采用科学合理的方法对临床数据进行分析评价,以确认医疗器械在其适用范围下的安全性、临床性能和/或有效性的持续进行的活动。医疗器械的临床评价依据产品的风险情况及成熟度,可采取以下三种路径进行研究,即免予临床评价路径、同品种等同性论证路径、临床试验路径。 在前期进行临床评价策略规划的基础上,通过技术指导制定整个项目的临床评价方案和策略,包括各个模块表格及对比项目制定,比对产品的相关资料调研收集、对比性能测试分析,同品种等同性论证报告编写,文献检索与筛选方案及报告编写,对比产品的投诉和不良事件数据收集及分析,以及针对收集的临床证据(文献、不良事件等数据)进行分析评估,论证对产品安全有效性的贡献,最终综合以上模块内容,汇总形成完整的临床评价报告。通过临床试验进行评价的路径,需要通过前期临床方案设计、遴选临床试验中心、临床试验中心立项及伦理审查、签署合同、启动招募、试验开展、数据管理及统计分析,以及穿插项目全程的临床试验监查及质量控制,最终形成临床试验报告。整个临床试验过程需严格按照《医疗器械临床试验质量管理规范》执行,保证按照临床试验方案开展项目,确保真实有效的验证拟申报产品的安全有效性,为下一步产品申报提供充分有效的临床验证报告。 同品种临床评价: · 筛选同品种产品 · 同品种产品等同性论证 · 检索临床数据及证据 · 临床评价报告撰写 临床试验: · 临床示范医院专家团队支持 · 临床试验机构遴选 · 临床方案设计 · 临床试验中心立项及伦理审查 · 临床试验省局备案 · 遗传资源审批(如需) · 临床监查与质量控制 · 临床数据管理与统计分析 · 临床试验报告编写 |